细胞黏附
在动物个体发育过程中,无论是受精、还是胚泡植入、形态发生、组织器官的形成以及成体结构与功能的维持,都离不开细胞的识别与黏附。
在胚胎发育过程中,具有相同表面特性的细胞通过特异性识别并黏附在一起形成内、中外三个不同的胚层;同样通过细胞的识别与黏附使具有相同表面特性的细胞聚集在一起形成组织和器官。
通常将这种在细胞识别的基础上,同类细胞发生聚集形成细胞团或组织的过程称为细胞黏附(cell adhesion)。
细胞黏附通过细胞表面特定的细胞黏附分子(cell adhesion molecule,CAM)介导细胞与细胞之间、细胞与细胞外基质之间的彼此黏着。黏附分子根据其分子结构与功能特性,可分为四大类:钙黏着蛋白(cadherin),选择素(selectin),免疫球蛋白超家族(Ig-superfamily,IgSF)和整联蛋白家族(integrin family)。细胞黏附分子多数需要依赖于二价阳离子Ca2+或Mg2+才起作用,这些分子介导的细胞识别与黏附还能在细胞骨架的参与下,形成桥粒、半桥粒、黏着带以及黏着斑等锚定连接结构(表10-2)。

黏附分子的结构特点:细胞黏附分子均为穿膜糖蛋白,由三部分组成:
- 胞外区,较长,肽链的N端部分带有糖链,是与配体识别的部位;
- 穿膜区,多为一次穿膜的α-螺旋;
- 胞质区,肽链的C端部分,一般较小,可与质膜下的细胞骨架成分或与胞内的信号转导蛋白结合。
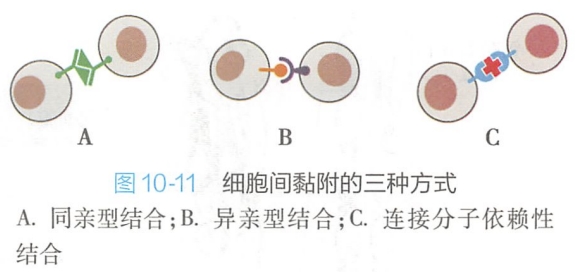
细胞黏附分子介导细胞识别与黏附的方式(图10-11): - 同亲型结合(homophilic binding),即相邻细胞表面的同种黏附分子间的相互识别与黏附,如钙黏着蛋白主要以这种方式介导细胞黏附;
- 异亲型结合(heterophilic binding),即两相邻细胞表面的不同种黏附分子间的相互识别与黏附,如选择素和整联蛋白主要以这种方式介导细胞黏附;
- 连接分子依赖性结合(linker--dependent binding),即相邻细胞黏附分子通过连接分子中介才能相互识别与黏着。
一、钙黏着蛋白家族
钙黏着蛋白是一类依赖于Ca2+的同亲型细胞黏附分子。不同的钙黏着蛋白都有其特定的组织分布,常根据其最初发现的组织类型命名,如上皮组织中的钙黏着蛋白称E-钙黏着蛋白(epithelial cadherin,E-cadherin);神经组织中的钙黏着蛋白称N-钙黏着蛋白(neural cadherin,N-cadherin);胎盘、乳腺和表皮中的钙黏着蛋白称P-钙黏着蛋白(placental cadherin,P-cadherin);血管内皮细胞中的钙黏着蛋白称VE-钙黏着蛋白(vascular endothelial cadherin,VE-cadherin)(表10-3)。上述几种最常见的钙黏着蛋白称为典型钙黏着蛋白(classical cadherin),具有细胞黏着和信号转导功能,其胞内或胞外结构域在序列组成上高度相似。此外还有一些非典型钙黏着蛋白,在结构序列组成上差异较大,主要功能是介导细胞黏着,如桥粒中的钙黏着蛋白。

(一)钙黏着蛋白分子结构特点
钙黏着蛋白分子典型结构为单次穿膜糖蛋白,在质膜中常以同源二聚体的形式存在,依靠Ca2+与相邻的细胞的钙黏着蛋白分子结合。在细胞培养时常用阳离子螯合剂EDTA破坏Ca2+或Mg2+依赖性细胞黏附。
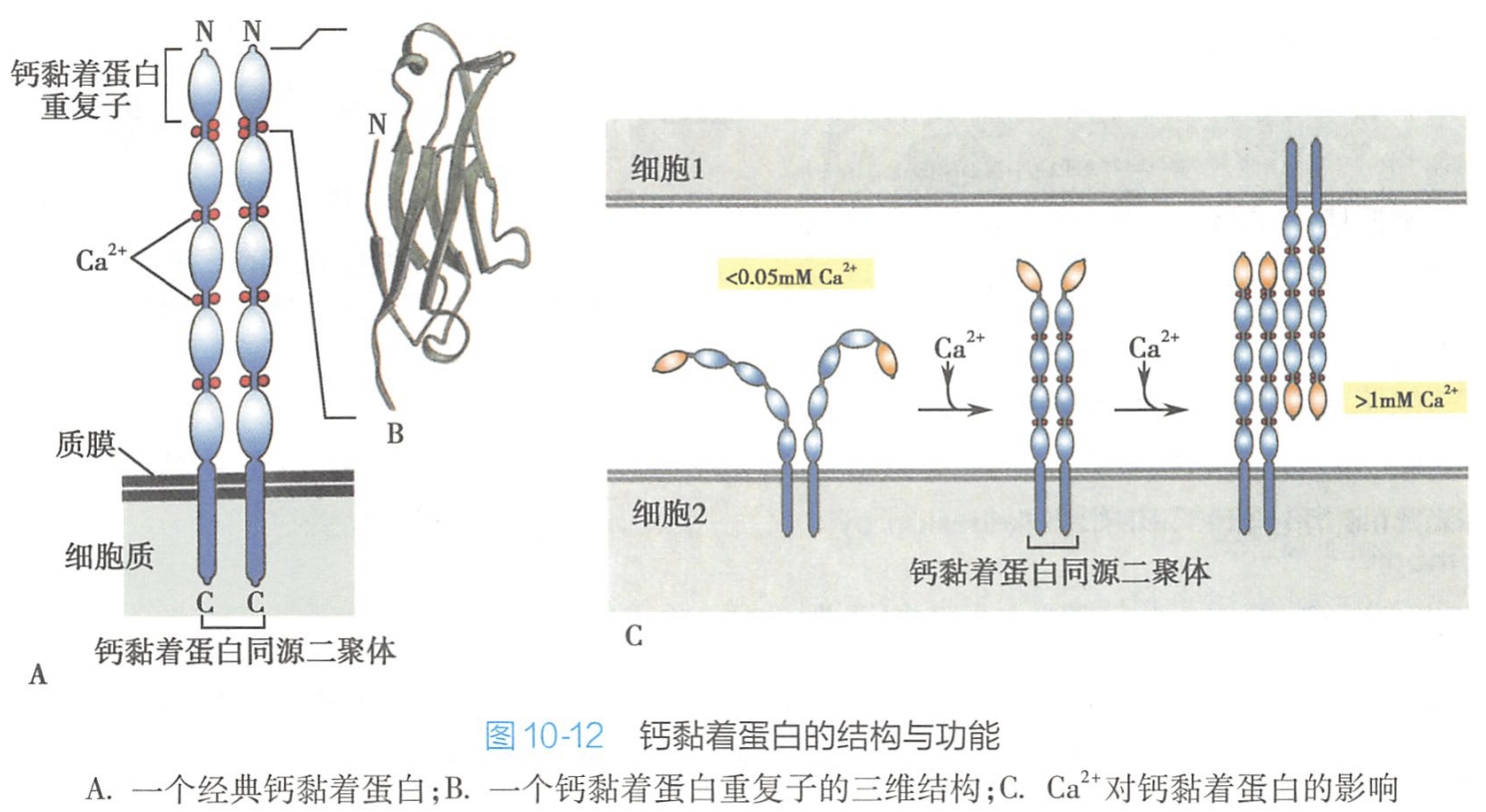
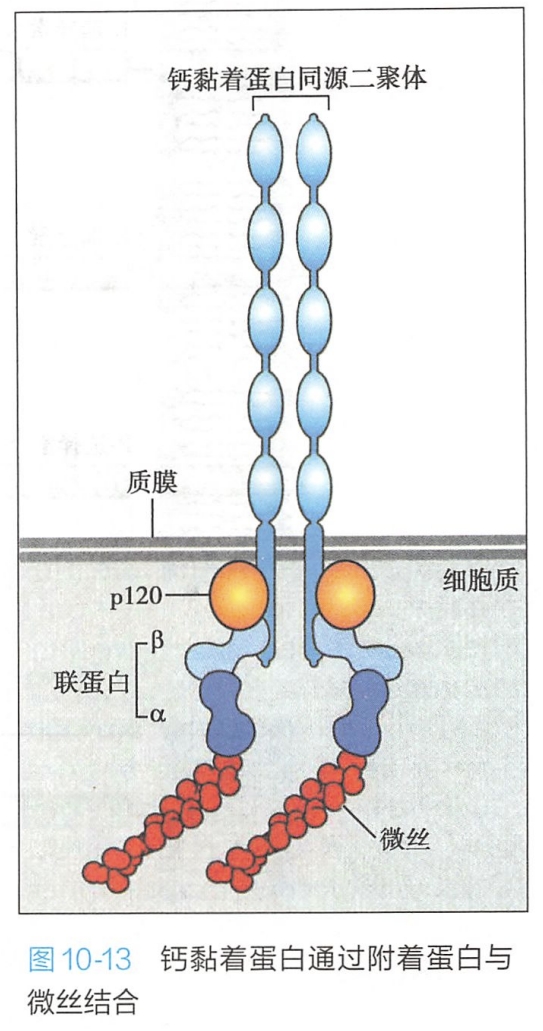
钙黏着蛋白的胞内部分是高度保守的区域,可以通过胞内衔接蛋白即联蛋白(α-catenin或β-catenin)与肌动蛋白丝连接;钙黏着蛋白胞内部分还与胞内信号蛋白(β-catenin或p120-catenin)相连,介导信号向细胞内传导,以调整细胞的功能活动。
(二)钙黏着蛋白的功能
1.介导细胞与细胞之间的同亲性细胞黏附
在胚胎和成人组织中,同类细胞需要具备自我标识与彼此黏附的特性,这一特性主要是由钙黏着蛋白分子在特定组织上的选择性表达所决定的。如E-钙黏着蛋白就是保持上皮细胞相互黏合的主要细胞黏附分子。
2.在个体发育过程中影响细胞的分化,参与组织器官的形成
在个体发育过程中,细胞通过调控钙黏着蛋白表达的种类与数量而决定胚胎细胞间的相互作用(黏附、分离、迁移、再黏附),影响细胞的分化,参与组织器官的形成。
如E-钙黏着蛋白在胚胎发育进入8细胞卵裂时期就开始表达,使松散的分裂球细胞紧密黏附;在外胚层发育形成神经管时,神经管细胞停止表达E-钙黏着蛋白,转而表达N-钙黏着蛋白;而当神经嵴细胞从神经管迁移出来时,神经嵴细胞则很少表达N-钙黏着蛋白,转而主要表达钙黏着蛋白-7;当神经嵴细胞迁移至神经节并分化成神经元时,又重新表达N-钙黏着蛋白。近年来在神经系统发现一个独特的钙黏着蛋白家族,称为原钙黏着蛋白(protocadherin),它们携带介导突触连接分子的密码,对于神经元识别靶细胞并建立起正确的突触联系起重要的作用。 #?
上皮细胞转型为间质细胞或间质细胞转型为上皮细胞是一个受控的可逆过程,称之为上皮-间质转换(epithelial--mesenchymal transition,EMT),是细胞转分化的一种方式。其分子机制是E-钙黏着蛋白的表达与否。细胞表达E-钙黏着蛋白后,分散的间质细胞会聚集在一起形成上皮组织;不表达E钙黏着蛋白的上皮细胞则从上皮组织迁移出来形成游离的间质细胞。
E-钙黏着蛋白的表达受到启动子区甲基化的影响,又受多种转录调控因子如Snail、Slug、Twist等的负调控起抑制作用。这种上皮-间质转型(EMT)在胚胎发育、器官的细胞更新和再生,以及某些多能干细胞的分化等过程均发挥重要的生理作用。
3.参与细胞之间稳定的特化连接结构
参与锚定连接。
- 在黏着连接中,钙黏着蛋白胞内区通过细胞内锚定蛋白α和β联蛋白(catenin)与肌动蛋白丝相连,形成细胞之间牢固连接的黏着带(图10-13);
- 在桥粒结构中,钙黏着蛋白家族的桥粒黏蛋白和桥粒胶蛋白的胞内区通过胞质斑与中间纤维相连形成牢固的连接结构。
4.一些钙黏着蛋白在锚定连接中起向细胞内传递信号的作用
如VE-钙黏着蛋白不仅参与内皮细胞间的黏附,还作为血管内皮生长因子的辅助受体,参与维持内皮细胞存活信号的传递。
二、选择素
选择素是一类依赖于Ca2+的异亲型细胞黏附分子,它们能特异性地识别并结合其他细胞表面寡糖链中的特定糖基,主要介导白细胞与血管内皮细胞或血小板的识别和黏附,在炎症反应和免疫反应中起重要作用。
选择素家族包括三种成员:
- L-选择素(leukocyte selectin)最早在淋巴细胞上作为归巢受体被发现,后来发现在各种白细胞上都表达;
- P-选择素(platelet selectin)主要位于血小板和内皮细胞上;
- E-选择素(endothelial selectin),表达于活化的内皮细胞上。
(一)选择素的分子结构
选择素是单次穿膜糖蛋白,其胞外区由三大结构域组成:即N-末端的C型凝集素(C lectin)样结构域、表皮生长因子(epithelial growth factor,EGF)样结构域以及与补体调节蛋白(complement control protein module,CCP)同源的结构域。
其中N-末端凝集素结构域是识别特异糖基,参与细胞之间选择性黏附的活性部位。所有选择素均可识别和结合一类特定的糖基(图 10-14),Ca2+参与该识别黏附过程。EGF样和CCP结构域具有加强分子间黏附以及参与补体系统调节等作用。
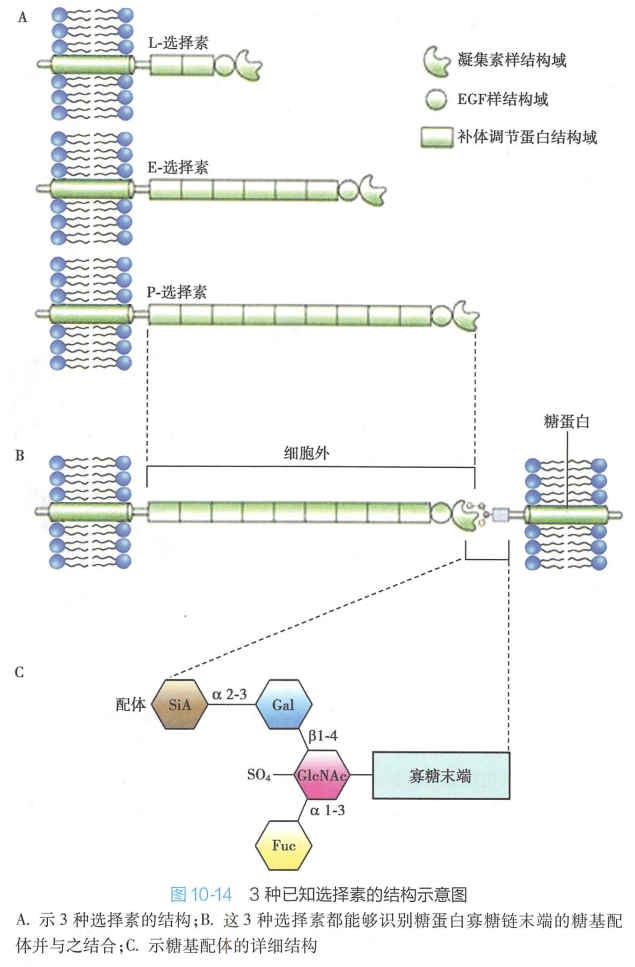
选择素分子的胞内区可通过锚定蛋白与细胞内微丝结合。
(二)选择素的功能
主要功能是参与白细胞与血管内皮细胞或血小板的识别与黏着,帮助白细胞从血液进入炎症部位。
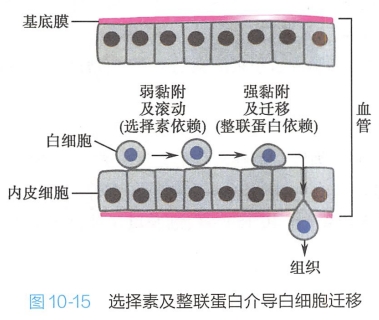
在炎症发生部位,血管内皮表达E-选择素,与白细胞和血小板上的寡糖链识别,由于选择素与白细胞表面的特异寡糖链亲和力较小,加上血流速度的影响,白细胞在炎症部位的血管中黏附-分离,再黏附-再分离,呈现滚动方式运动,随后激活了自身整联蛋白,由后者介导白细胞与血管内皮细胞较紧密地结合在一起,并使白细胞经内皮细胞间隙迁移至组织(图10-15)。白细胞以这种机制富集到炎症发生的部位。
三、免疫球蛋白超家族
免疫球蛋白超家族(immunoglobin-superfamily,Ig-SF)是一类分子结构中含有类似免疫球蛋白结构域不依赖Ca2+的细胞黏附分子。这类分子的胞外区由一个或多个免疫球蛋白(Ig)样结构域组成。
(一)Ig-SF黏附分子的分类
每一个Ig结构域都是由90~110个氨基酸残基形成的紧密折叠结构,其间有二硫键相连接。
- 有的介导同亲型细胞黏着
- 神经细胞黏附分子(neural cell adhesion molecule,N-CAM或NCAM)
- 血小板-内皮细胞黏附分子(PE-CAM或PECAM);
- 有的介导异亲型细胞黏着
- 细胞间黏附分子(I-CAM或ICAM)
- 血管细胞黏附分子(V-CAM或VCAM)等。
大多数Ig-SF黏附分子介导淋巴细胞和免疫应答所需要的细胞(巨噬细胞、其他淋巴细胞和靶细胞)之间的特异的相互作用。但一些Ig-SF成员,如N-CAM介导非免疫细胞的黏着。
(二)Ig-SF黏附分子的功能
1.一些Ig-SF成员通过同亲型细胞黏着机制参与神经细胞黏附
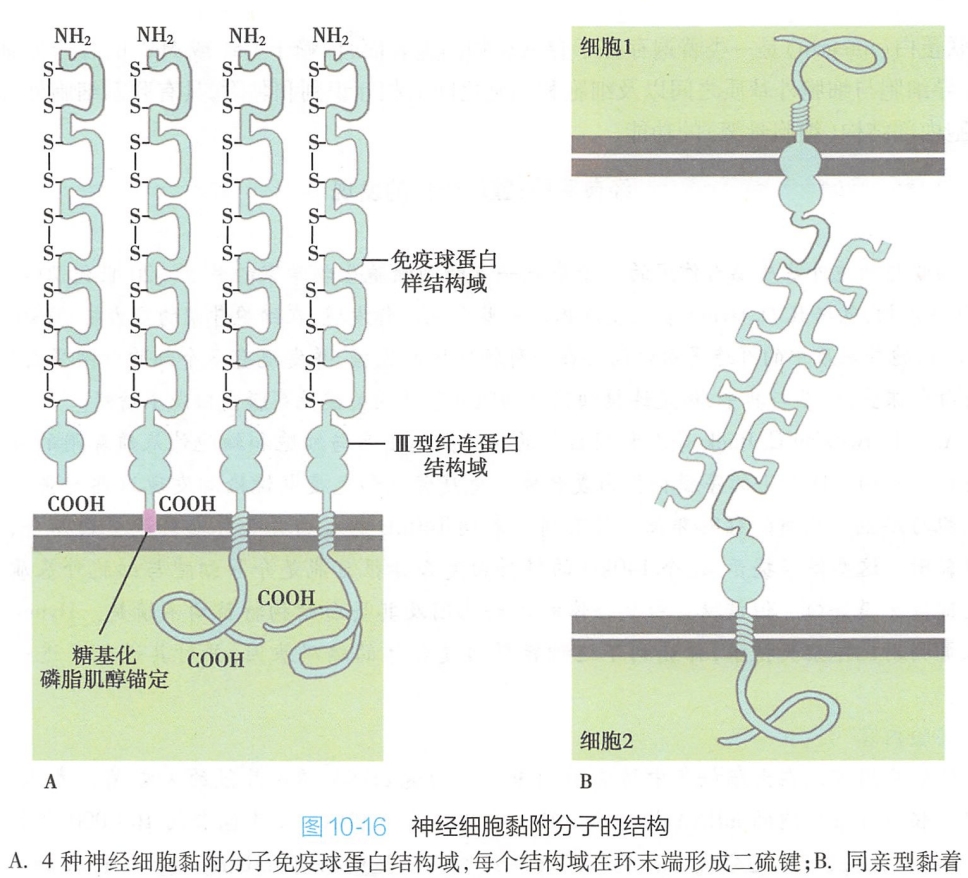
表达于神经细胞的Ig-SF黏附分子成员,由单一基因编码,hnRNA的选择性剪接及糖基化的不同形成了20余种不同的N-CAM,其配体也为N-CAM。
分析发现,所有N-CAM的胞外区都有5个免疫球蛋白样的结构域,它们通过同亲型黏着机制与相邻细胞同类分子结合黏附在一起,与神经系统的发育、轴突的生长和再生以及突触的形成密切相关(图10-16)
2.一些Ig-SF成员通过异亲型细胞黏着机制参与血管内皮细胞与白细胞的黏附
例如, V-CAM是一类表达于血管细胞的Ig-SF黏附分子成员,可与白细胞表面的α4β1整联蛋白(其配体)相结合,使白细胞沿内皮滚动并固着于炎症部位的血管内皮,发生铺展,进而分泌水解酶而穿过血管壁。
3.一些Ig-SF成员参与免疫细胞的识别与黏附
I-CAM是另一组Ig-SF黏附分子,有多种类型。内皮细胞的I-CAM可通过与白细胞表面的整联蛋白分子结合,在炎症反应中发挥作用。
有的类型只在T细胞、单核细胞和中性粒细胞表达。I-CAM在淋巴系统抗原识别、细胞毒T淋巴细胞功能发挥以及淋巴细胞的募集方面起重要作用。 #免疫
4.一些Ig-SF成员参与血小板和内皮的识别与黏附
PE-CAM主要表达于血小板和内皮细胞,既可以同亲型黏着方式又可以异亲型黏着方式与其他黏附分子结合,在血管内皮细胞的紧密黏附中起主要作用。
四、整联蛋白家族
整联蛋白(integrin)是一类普遍存在于脊椎动物细胞表面,依赖于Ca2+或Mg2+的异亲型细胞黏附分子,介导细胞与细胞外基质之间以及细胞和细胞之间的相互识别和黏附,具有联系细胞外部作用因素与细胞内部结构(细胞骨架)的功能。
(一)整联蛋白的分子特点
由α和β两个亚基组成的异二聚体,两亚基均为穿膜蛋白。24种不同的α亚基和9种不同的β亚基,它们相互组合成不同的整联蛋白,可与不同的配体结合。
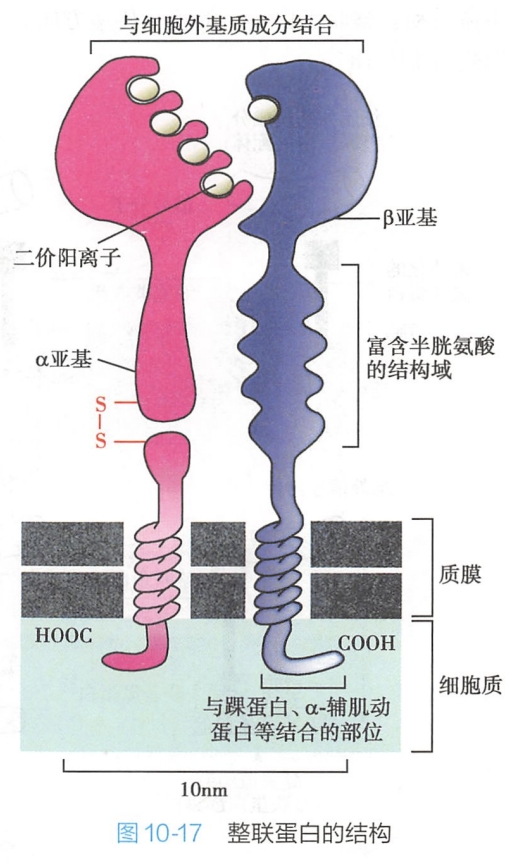
整联蛋白α和β亚基均由胞外区、跨膜区和胞内区三个部分组成。
- 由α和β亚基胞外区组成的球状头部区是整联蛋白分子与配体结合部位。整联蛋白的胞外区可以通过自身结构域与纤连蛋白、层粘连蛋白、胶原等含有Arg-Gly-Asp(RGD)三肽序列的细胞外基质成分结合(表10-4),从而介导细胞与细胞外基质的黏着。典型结构有黏着斑和半桥粒。
- 胞内区很短,只含有30~50个氨基酸,可通过胞内的一些连接蛋白(踝蛋白、α-辅肌动蛋白、细丝蛋白、纽蛋白等)与细胞内的肌动蛋白丝等细胞骨架成分相互作用(图10-17)。
从表10-4可以看出,不同细胞表达的整联蛋白在组成上不尽相同;此外,不仅同一种整联蛋白可以与一种以上的不同配体相结合;而且,同一种配体也可以与多种不同的整联蛋白相结合。

(二)整联蛋白的功能
1.整联蛋白介导细胞与细胞外基质间的连接或相互作用
整联蛋白介导细胞与细胞外基质的锚定连接。由β1亚基组成的整联蛋白为细胞外基质蛋白的受体,其胞外区具有与大多数细胞外基质蛋白,如蛋白聚糖、纤连蛋白、层粘连蛋白等含有RGD三肽序列结合的位点,因此可以使细胞黏着于细胞外基质上。
整联蛋白胞外区可以通过自身结构域识别含有RGD的三肽序列的配体。体外实验证实,含有RGD序列的人工合成肽可以竞争性阻断细胞与纤连蛋白的结合,使培养的细胞不能贴壁生长。
血凝块的形成始于血小板的凝聚,由血小板特异的整联蛋白αⅡbβ3与血浆中含有RGD序列的纤维蛋白原结合,介导了血小板的凝聚(图10-19)。
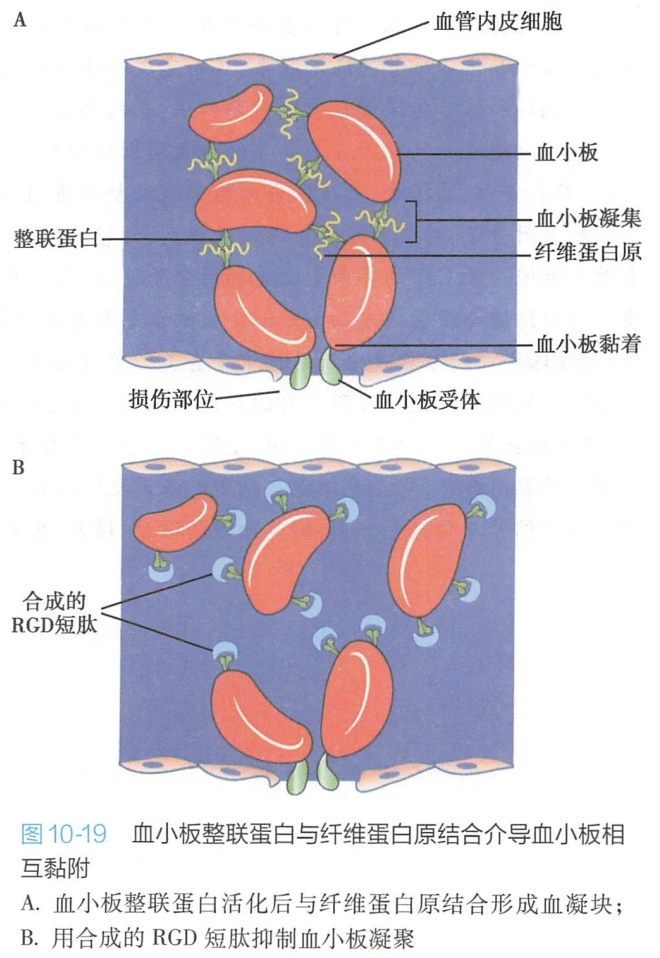
动物实验表明,含有RGD序列的人工合成肽可以竞争性地阻止血小板整联蛋白与血浆中纤维蛋白原结合,从而预防血凝块的形成。这一发现使人们设计出一种新的非肽类抗凝血药物,它们类似于RGD结构,但只与血小板整联蛋白结合。 #生理
2.整联蛋白也介导细胞间相互作用
在一些细胞表面有与整联蛋白结合的特异性配体(如Ig超家族成员V-CAM),可以介导细胞间的反应。如由β2亚基组成的整联蛋白能使白细胞在感染部位的血管内皮细胞上黏附,白细胞由此得以迁移出血管进入炎症部位。
β3亚基组成的整联蛋白见于血小板和其他类型的细胞,可以介导血小板的黏附,参与凝血过程。 #生理
3.整联蛋白在信号传递中发挥重要作用
整联蛋白与其配体结合后聚集成簇,不但借以形成稳定、牢固的结合,并可启动信号转导,调节细胞的行为,如细胞的迁移、增殖、分化、存活和凋亡等基本生命活动。整联蛋白参与的信号传递方向有“由内向外”(inside out)及“由外向内”(outside in)两种形式(图10-18)。(两者的区别实际上是整联蛋白后与胞外基质黏附或先与胞外基质黏附)
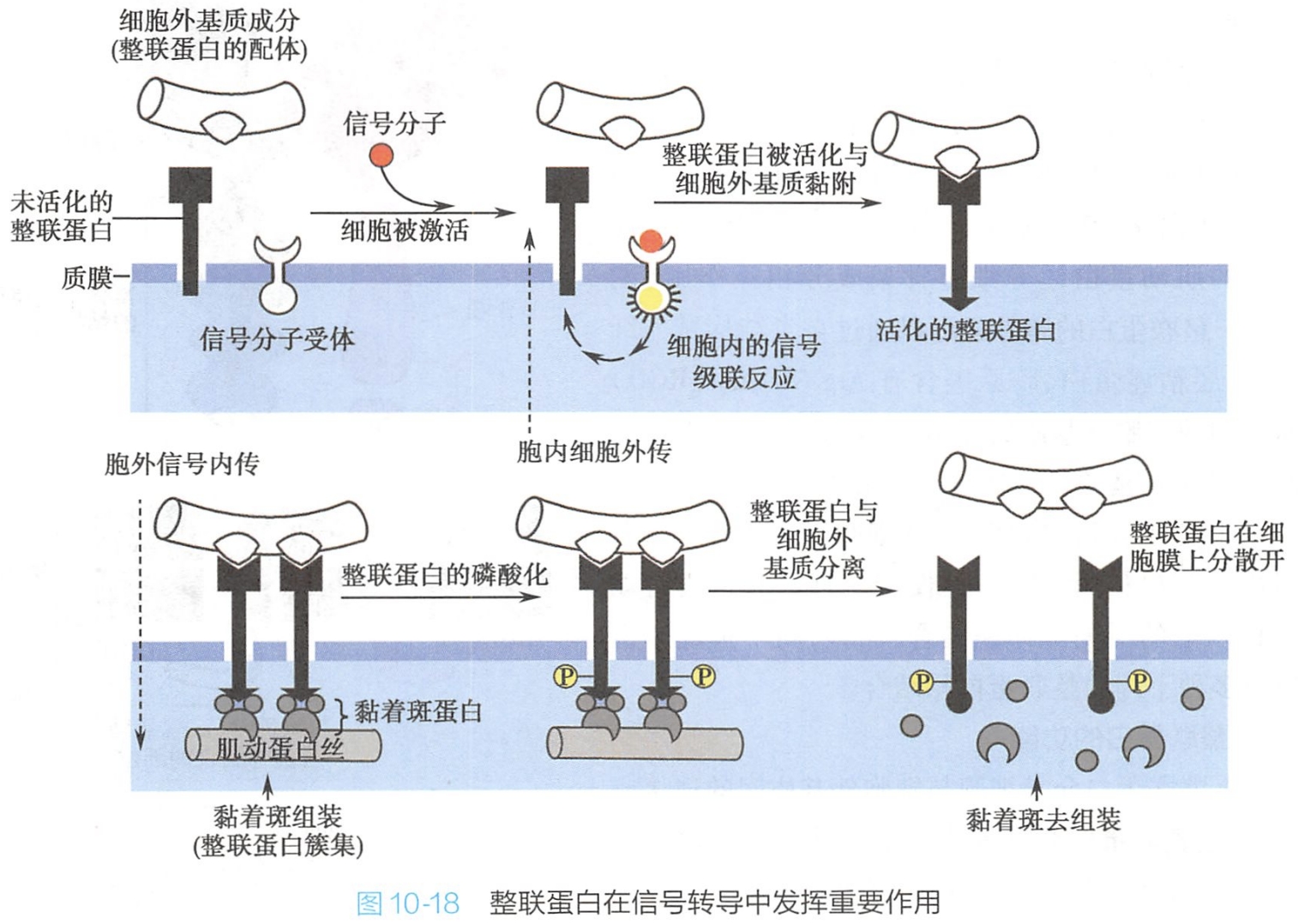
(1)由内向外
整联蛋白往往以无活性的形式存在于细胞表面,当细胞内事件启动胞内信号传递后(实际上第一步还是细胞外信号啊),激活整联蛋白,使其胞内结构域发生构型改变,继而诱导胞外结构域发生构型变化,从而增强整联蛋白与其他胞外配体的结合能力,最后介导细胞黏着。
这种由细胞内信号的启动,通过改变细胞本身的功能状态,将胞内信号由整联蛋白胞内区传递到细胞外,促进整联蛋白与配体结合的方式称为“由内向外”的信号转导。一些蛋白,如肌动蛋白结合蛋白和黏着斑激酶(focal adhesion kinase,FAK)等胞内蛋白,能直接与整联蛋白胞内区结合,通过磷酸化或去磷酸化作用调节整联蛋白的活性,影响其功能。
“由内向外”的信号转导主要控制细胞黏附力,对于血小板和白细胞介导的黏附反应是非常重要的。
(2)由外向内
整联蛋白还可作为受体介导信号从细胞外环境向细胞内的转导,这种方式称为“由外向内”的信号转导。
例如,细胞在体外培养时,大多数正常细胞必需贴附在细胞外基质上才能生长,如果细胞不能贴附在细胞外基质上就会停止分裂直至死亡,这种现象叫做锚定依赖性生长。其原因是因为它们的整联蛋白不能与细胞外基质配体相互作用,致使无法向细胞内传递存活信号。
现在知道,这种整联蛋白介导的“由外向内”的信号转导分子依赖细胞内酪氨酸激酶-FAK。整联蛋白与配体结合可使整联蛋白发生簇集,导致FAK自主磷酸化而与Src激酶结合,FAK/Src复合体使多个下游分子磷酸化,活化FAK-MAPK和FAK-PI3K等通路,直接或间接传递信号,调控细胞增殖、黏附与伸展、迁移等多种细胞功能。